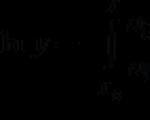Составление формул по валентности. «Составление химических формул бинарных соединений по валентности
Урок химии в 8 классе № 14
Тема: Составление формул соединений по валентности.
Цель урока: научить применять полученные знания для проведения расчетов по составлению формул по валентности вещества.
Планируемые результаты обучения:
Учащиеся должны уметь формулировать определение “валентность”, знать валентность атомов водорода и кислорода в соединениях, определять по ней валентность атомов других элементов в бинарных соединениях,
Уметь разъяснять смысл понятия “валентность” и последовательность действий при определении валентности атомов элементов по формулам веществ.
Организационные формы: беседа, индивидуальные задания, самостоятельная работа.
Средства обучения: алгоритм определения валентности по формулам веществ и составления химических формул соединений по валентности элемента
Демонстрационное оборудование: презентация
Оборудование для учащихся: «Алгоритм составления химических формул по валентности».
Ход урока
I. Ориентировочно-мотивационный этап.
.Учитель. Сегодня мы с вами совершим поход в страну Химляндию, где проживает более ста тысяч различных химических веществ. На пути будет много препятствий, поэтому необходимо использовать все свои умственные способности, знания, полученные на предыдущих уроках. Прежде чем отправиться в путь, проведем разминку.
Химическая разминка
Задания по пройденным темам
1.Найдите «лишнее вещество», т.е. такое, которое не образует с остальными однородную группу: H 2 SO 2 Na Br 2 Al 2 O 3 N 2 O 5 (N а – атом среди молекул)
2..Найдите «лишнее вещество», т.е. такое, которое не образует с остальными однородную группу: O 2 N 2 Сa О Mg Li Na (Ca О – сложное вещество, среди простых)
Учитель. Сейчас нам нужно собрать вещи для похода
3. .Выбери названия тел: золото, парафин, пакет, стекло, кружка, карандаш, фонарик, вода, свеча.
4. Выбери чистые вещества: воздух, ртуть, морская вода, соль, серебро, водород , нефть, железо, туман.
У нас на пути скалы. Нам нужно построить мост.
5. Установи соответствие между химическим символом элемента и его названием
Теперь на нашем пути речка. Для того чтоб ее перейти надо пройти следующее задание.
6. Как произносятся формулы следующих веществ? CuO, ZnO, P 2 O 5, NO 2 , SO 3 , Al 2 O 3, Н 2 О, SO 2.
Молодцы нам осталось пройти лес
Работа у доски
1.Рассчитайте относительную молекулярную массу данных веществ: Na I , CuO
2. Рассчитайте относительную молекулярную массу данных веществ: Al 2 O 3 , MgO
( Класс выполняет в тетради)
Мы справились со всеми заданиями. Молодцы!
II. Операционно-исполнительный этап.
Актуализация опорных знаний
Последний этап высокая гора. Перед нами нелегкая задача, нам нужно много усилий для того чтоб подняться, нам помогут наши знания. Вспомните, благодаря чему элементы соединяются между собой?
Дайте определение валентности.
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Как обозначается валентность? (Валентность обозначается римскими цифрами)
Какие бывают виды валентности? (постоянная и переменная)
Перед трудным подъёмом в гору, давайте сделаем ещё одну разминку.
Упражнение: определить валентность элементов в веществах(Снежный ком, каждый определяет валентность и передает ход другому) Al 2 O 3 , ZnO , SO 3 , K 2 O , KI , CO 2 , Na 2 O , P 2 O 5
Скажите, необходимо ли знать валентность химических элементов? (чтобы составлять химические формулы соединений).
Сообщение темы
Запишем тему урока в тетрадь. Какую цель мы поставим перед собой?
Итак, теперь нам надо пройти нашу гору целыми и невредимыми, для этого нам нужно выучить правила.
Алгоритм составления химической формулы по валентности элемента.
Последовательность действийСоставление формулы оксида фосфора
1. Написать символы элементов
Р О
2. Определить валентности элементов
V II
P O
3. Найти наименьшее общее кратное численных значений валентностей
5 2 = 10
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов
10: 5 = 2, 10: 2 = 5;
P: О = 2: 5
Правила мы уже усвоили, начнем подъем.
Упражнение: составить химические формулы по валентности элементов. Задание в рабочей тетради (Работа с учебником)
III. Оценочно-рефлексивный этап.
Мы благополучно добрались до места, можем и отдохнуть.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь.
Составьте химические формулы по валентности элементов А
LCl
,
KO
,
CuO
(
II
),
SnS
(
IV
)
Составьте формулы оксидов:
N
(
IV
),
Mn
(
VII
) ,
S
(
VI
),
Na
(
I
)
,
Cr
(
III
).
Исправьте ошибки, допущенные в некоторых формулах: NO 3, BO 3, MgO 2 , AlI 2 , NaS
IV. Подведение итогов урока
Сегодня мы с вами совершили путешествие, скажите, вам понравилось? Какие знания вы принесли с похода?
Домашнее задание: Параграф учебника.
Карточки с заданиями
Составьте формулы веществ
«3» NaO, CO(IV), BO (III)
«4» SnO (IV), FeO (III), MnO(VI)
Тема урока: Составление химических формул бинарных соединений по валентности.
«У научного изучения предметов две основные или конечные цели: предвидение и польза»
Д. И. Менделеев
Цели:
Образовательные : рассмотреть понятие «валентность» как атомность элемента, научить учащихся определять валентность в бинарных соединениях, познакомить учащихся с различными видами валентности, повторить понятия о кратном данного числа, о наименьшем общем кратном нескольких чисел, повторить правило нахождения НОК нескольких чисел и применение этого правила; обратить внимание учащихся на интеграцию курсов химии и математики.
Развивающие: развивать познавательный интерес учащихся, вырабатывать умение логически рассуждать, применять ранее полученные знания, грамотно выражать свои мысли.
Воспитательные: способствовать воспитанию интереса к предмету, к результату своего труда, развивать умение работать в парах, коллективно, оценивать ответы своих товарищей.
Планируемые результаты обучения:
Учащиеся должны знать:
определение понятия “валентность”;
валентность атомов водорода и кислорода в соединениях.
Учащиеся должны уметь:
определять по валентности атомов водорода и кислорода валентность атомов других элементов в бинарных соединениях;
определять валентность атомов элементов по формулам веществ, используя алгоритм для решения задач.
Основные понятия: валентность, постоянная и переменная валентность, бинарные соединения, наименьшее общее кратное.
Тип урока: комбинированный.
Средства обучения: алгоритм определения валентности.
Оборудование: Периодическая система химических элементов Д. И. Менделеева, шаростержневые модели молекул, таблица «Алгоритм определения валентности».
Ход урока
Организационный этап: приветствие учащихся.
Актуализация опорных знаний.
Фронтальная беседа учителя химии с учащимися по теме “Химическая формула”.
При изучении химии очень важно научиться составлять формулы химических веществ.
Что выражает химическая формула? (состав определенного вещества, взятого в чистом виде)
Химическая формула – это условное обозначение вещества, атома, молекулы, иона с помощью символов элементов, числовых и вспомогательных знаков.
По химической формуле мы можем определить:
Тип вещества,
Качественный и количественный состав,
Относительную молекулярную массу,
Массовую долю химического элемента в данном веществе,
Валентность химических элементов.
Все вещества состоят из атомов. Одним из основных свойств атомов является способность образовывать химические связи. Атомы разных элементов могут образовывать определенное, свойственное им количество связей.
Давайте сравним качественный и количественный состав в молекулах: HCl , H 2 O, NH 3 , CH 4 .
Что общего в составе молекул? (наличие атомов водорода)
Чем эти вещества отличаются друг от друга? (в этих веществах разное количество атомов водорода)
Атом водорода не может присоединить более одного атома другого химического элемента, поэтому валентность водорода принята за единицу. И поэтому с валентностью водорода сравнивают валентность всех других элементов.
Примеры:
HCl - один атом хлора связан с одним атомом водорода;
H 2 O - один атом кислорода связывает два атома водорода;
NH 3 - один атом азота связывает три атома водорода;
CH 4 - один атом углерода связывает четыре атома водорода.
Почему различные атомы удерживают различное количество атомов водорода?
(каждый атом образует с другими атомами определенное количество связей).
Это называют валентностью.
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность обозначается римскими цифрами.
Записи на доске и в тетрадях:
| I I | I II | I III | I IV |
Валентность атома водорода принята за единицу - I, а у кислорода – II.
Сообщение учащегося о валентности.
В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э. Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
В конце 50-х гг. XIX вeка А. С. Купер и А. Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А. М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г. вскрыл зависимость валентности элемента от его положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В. Гейтлер и Ф. Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода H 2 .
Беседа с учащимися: Что такое валентность?
Определение валентности в разных источниках звучит по-разному. Давайте подумаем, какое из этих трех определений более совершенно и в чем недостатки других.
1-й ряд
«Валентность
химического элемента – способность его атомов соединяться с другими атомами в определенных соотношениях».
2-й ряд
«Валентность
– способность атомов одного элемента присоединять определенное количество атомов другого элемента».
3-й ряд
«Валентность
– свойство атомов, вступая в химические соединения, отдавать или принимать определенное количество электронов или объединять электроны для образования общих для двух атомов электронных пар ».
Обсуждение в группах, приходим к выводу, что 3-е определение наиболее точно отражает суть определения валентности.
Изложение нового материала:
Тема нашего урока:
Составление формул бинарных соединений по валентности.
Новый материал запоминается легче, если он нанизывается на уже полученные знания. Поэтому сейчас предстоит работа с извлечением этого материала из памяти. И в этом вам поможет учитель математики.
Учитель ведет диалог с учениками:
Учитель: перечислите несколько чисел, кратных 12.
12, 24, 36, 48 ….
Учитель: перечислите несколько чисел, кратных 18.
18, 36, 54, 72……
Учитель: назовите числа, которые кратны и 12 и18.
36 и 72 и т.д.
Учитель: назовите наименьшее общее кратное 12 и 18.
Учитель: Сформулируйте определение наименьшего общего кратного нескольких чисел.
Наименьшим общим кратным нескольких чисел называется самое меньшее натуральное число, которое делится на каждое из данных чисел.
Учитель: сформулируйте правило нахождения наименьшего общего кратного двух или нескольких чисел.
Чтобы найти НОК двух или нескольких чисел, надо разложить эти числа на простые множители, затем, взяв разложение одного из них, умножить его на недостающие простые множители из разложений других чисел.
Учитель предлагает следующее упражнение:
№1 . Найдите А) НОК (48, 90); Б) НОК (6, 15, 20)
Решение:
А) 48/2 90/2 Б) 6/2 15/3 20/2
24/2 45/3 3/3 5/5 10/2
12/2 15/3 1/ 1/ 5\5
НОК (48,90) = 2 4 *3*3*5 НОК (6,15,20) = 2 3 * 5 * 3
НОК (48,90)= 720 НОК (6,15,20) = 60
Ответ : А) 720; Б) 60.
Учитель: чему равно НОК двух взаимно простых чисел?
НОК двух взаимно простых чисел равно их произведению.
№2. Найдите НОК (7,11)
Учитель: Как вы помните, существует еще один способ нахождения НОК чисел – это способ подбора.
Найдите НОК следующих чисел способом подбора:
А) 10 и 2 Б) 14 и 21 В) 20 и 15 Г) 2; 3 и 5
Ответы: А) 10 Б) 42 В) 60 Г) 30.
Учитель: Ребята, мы с вами повторили, как можно найти НОК двух или нескольких чисел. А теперь вы познакомитесь с тем, как эти знания применяются в химии при определении валентности.
В. Гете когда-то сказал: «Просто знать еще не все, знания нужно уметь использовать».
Определение валентности элементов по формулам в бинарных соединениях.
Помнить: в формулах бинарных соединений число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента.
Записать формулу вещества. Р 2 О 5
Римской цифрой указать валентность одного из элементов. Р 2 О 5 (II)
Определить валентность другого химического элемента. Р 2 О 5
Х*2= II *5 X = V
Составление химических формул бинарных соединений по валентности элементов.
Записываем символы химических элементов, входящих в состав формулы, проставляя над ними соответствующие значения валентности:
СаО, В 2 О 3 , СО 2 ,
Составляем формулу соединения по валентности:
а) СаО: если валентности химических элементов равны, то индексы не ставим.
б) В 2 О 3: если значения валентностей не делятся друг на друга, ставим значения валентностей крест накрест.
в) СО 2: если валентность одного элемента делится на валентность другого, то значение большей валентности разделить на значение меньшей и полученное число в виде индекса поставить возле элемента с меньшей валентностью.
Упражнение: определить валентность элементов в веществах: ученики цепочкой выходят к доске. Задание проецируем на доску.
SiH 4 , CrO 3 , H 2 S, CO 2 , CO, SO 3 , SO 2 , Fe 2 O 3 , FeO, HCl, HBr, Cl 2 O 5 , Cl 2 O 7 , РН 3 , K 2 O, Al 2 O 3 , P 2 O 5 , NO 2 , N 2 O 5 , Cr 2 O 3 , SiO 2 , B 2 O 3 , SiH 4 , Mn 2 O 7 , MnO, CuO, N 2 O 3 .
Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний. Для выполнения данного задания учащиеся получают «Алгоритм определения валентности» и задания трех уровней. Каждый учащийся выбирает свой уровень задания.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений: NH 3 , Au 2 O 3 , SiH 4 , CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe 2 O 3 , CrO 3 , CuO, K 2 O, СаH 2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул: N 2 O, NO, N 2 O 3 и проставьте валентности над каждым элементом.
| Алгоритм определения валентности | Пример |
|
| 1. Запишите формулу вещества. | ||
| 2. Обозначьте известную валентность элемента | ||
| 3. Найдите число единиц валентности атомов известного элемента, умножив валентность элемента на количество его атомов | ||
| 4. Поделите число единиц валентности атомов на количество атомов другого элемента. Полученный ответ и является искомой валентностью | 2 | 2 |
| 5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
Проводим взаимопроверку выполненного задания (учащиеся обмениваются тетрадями).
Работа над ошибками: о тветы на доске.
Подведение итогов урока.
Беседа с учащимися:
Какую проблему мы поставили в начале урока?
К какому выводу мы пришли?
Дать определение “валентности”.
Как определить НОК?
Чему равна валентность атома водорода? Кислорода?
Как определить валентность атома в соединении?
Оценка работы учащихся.
Домашнее задание: учебник Г. Е. Рудзитис, Ф. Г. Фельдман §17, стр. 60, упр. 1, 2, 4, 6
Проблемный вопрос: Почему водород и литий имеют постоянную валентность, а гелий не имеет валентности?
«Как преуспеть ученикам – догонять тех, кто впереди, и не ждать тех, кто позади»
Аристотель
Желаем вам всегда быть впереди.
C
оставление
бинарных формул
по валентностям химических элементов
|
Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов. |
|||||||||||||||||||||
|
ОКСИДЫ |
СУЛЬФИДЫ |
ХЛОРИДЫ |
|||||||||||||||||||
|
Оксид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является кислород, с валентностью (II) . Na 2 ОCaО P2О5 |
Сульфид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является сера, с валентностью (II) . K 2 SMgS Al 2 S 3 |
Хлорид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является хлор, с валентностью (I) . FeCl 3NaCl CaCl 2 |
|||||||||||||||||||
|
Общая формула где Э – элемент; Х – валентность элемента |
Общая формула Задание - Алгоритм Составьте бинарные формулы соединений по их названиям:Оксид калия, сульфид алюминия, хлорид меди (II ) Решение:
Запомните! Особенности составления химических формул соединений. 1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже. Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO 3. В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов. 2) Атом металла стоит в формуле на первое место. 2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца. Теперь вы сами можете написать формулы любых соединений металлов с неметаллами. 3) Атом металла ставится в формуле на первое место. Задания для закрепления №1. Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы: III №2. Составьте формулы молекул для следующих соединений: 1) меди и кислорода, 2) цинка и хлора, 3) калия и йода, 4) магния и серы. №3. Используя материалы лекции составьте бинарные формулы следующими элементами:А) бор и кислород; Б) алюминий и хлор; В) литий и сера.
Используя материалы лекции составьте формулы веществ по их названиям: №6.
Определите валентность химических элементов по формулам их соединений: NH 3 FeCl 3 Cr 2 O 3 SO 3 CH 4 P 2 O 5 | ||||||||||||||||||||
§ 1 Валентность химических элементов
В свое время, состав всех веществ был установлен на основании данных эксперимента. Однако можно составлять химические формулы, не прибегая к предварительному выполнению сложных опытов, требующих длительной, кропотливой работы.
Если сравнить между собой формулы таких веществ, как вода H2O, оксид кальция СаО, оксид алюминия Al2O3, оксид углерода СО2, оксид фосфора Р2О5, оксид серы SО3 и оксид хлора Cl2О7, то можно заметить, что кислород во всех этих соединениях присоединяет к себе неодинаковое число атомов других химических элементов.
Для определения состава бинарных или двухэлементных, то есть состоящих из атомов двух химических элементов соединений, и составления их формул, достаточно знать валентность химических элементов.
Валентность (от латинского слова Valentia - «сила») - свойство атома химического элемента присоединять или замещать определённое число атомов другого химического элемента
Поскольку атомы в молекуле соединены между собой химическими связями, валентность определяется числом простых (одинарных) химических связей, которые данный атом образует с другими атомами.
§ 2 Определение валентности по формулам соединений
Как это можно представить себе, если не прибегать к теории строения атома? Каждый атом имеет определенное число потенциальных химических связей - валентных возможностей.

Например, водород - одну, кислород и кальций - по две, алюминий - три, углерод - четыре, фосфор - пять, сера - шесть, хлор - семь. Соединяться друг с другом эти атомы могут, только используя эти самые валентные возможности.
Поэтому атомы химических элементов и образуют соединения, подчиняясь закону постоянства состава.
Закон постоянства состава утверждает, что вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.

Способность элементов проявлять то или иное значение валентности определяется строением их атомов. Поскольку строение атомов обычно изучается позднее, научимся определять валентность, исходя из положения элементов в периодической системе.
Для этого следует учитывать, что каждая группа (вертикальный столбец) элементов состоит из двух подгрупп: главной А и побочной В.

Элементы-металлы, располагающиеся в главных подгруппах I и II групп, проявляют постоянную валентность, равную номеру группы. Это же относится и к алюминию (III группа). А вот металлические элементы IV группы (главная подгруппа) олово и свинец служат исключением и проявляют переменную валентность, численно равную 2 и 4. Длямногих металлов побочных подгрупп также характерно наличие переменной валентности, однако высшее значение валентности обычно равно номеру группы!

Большая часть неметаллов, располагающихся в главных подгруппах групп с четвёртой по седьмую, проявляет переменную валентность. В ряду возможных значений валентностей неметаллов следует выделять высшую и низшую. Высшая валентность равна номеру группы, низшая - разности, полученной вычитанием числа, равного номеру группы, из числа 8. Например: высшая валентность элемента фосфора, стоящего в V группе, равна 5,
низшая: 8-5=3. Следовательно, валентность фосфора переменная - 3 и 5. Следует помнить, что высшая валентность неметаллов проявляется только в соединениях с кислородом, а низшая - в соединениях с металлами и водородом. Валентность водорода всегда во всех соединениях равна 1, валентность кислорода всегда 2.
§ 3 Составление химических формул по валентности
Для составления формул сложных веществ, состоящих из атомов двух неметаллов, следует учитывать, что высшую валентность проявит тот элемент, который стоит в периодической системе левее или ниже, а низшую - соответственно тот, который стоит правее или выше.
Составляем формулы и названия веществ по валентности, используя следующий алгоритм:
1. записываем знаки элементов (по наличию) в порядке: металл, водород, неметалл, кислород;
2. расставляем значения валентностей элементов по периодической системе химических элементов;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность, если она не постоянная.

Составим формулу и название для вещества, состоящего из атомов фосфора и кислорода:
1. записываем знаки Р и О;
2. валентность фосфора высшая, равна 5, валентность кислорода, как и во всех соединениях равна 2;
3. наименьшее общее кратное 10
10/5=2, пишем индекс у знака Р
10/2=5, пишем индекс у знака О
получилось Р2О5;
4. назовем вещество: корень латинского названия кислорода «оксигениум» окс, к нему прибавляем суффикс ид, получаем оксид. Русское название первого элемента - фосфор, валентность его переменная, равная 5. Получилось название «оксид фосфора 5».
§ 4 Определение названия вещества по химической формуле
Таким образом, при составлении названия вещества, имеющего определенную химическую формулу, необходимо указывать валентность, а чтобы ее указать, необходимо определить. По периодической системе это получается не всегда. Определить валентность и составить название веществаможно, используя алгоритм:
1. указать валентность известного элемента;
2. умножить указанную валентность на соответствующий индекс;
3. полученный результат делим на индекс элемента с неизвестной валентностью;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность.
Определим валентность и составим название вещества, имеющего формулу CrO3:
1. валентность кислорода постоянна и равна 2;
3. 6/1=6. Валентность хрома равна 6;
4. название вещества - оксид хрома 6.
Теперь научимся составлять формулу по названию вещества
1. записываем знаки химических элементов в нужном порядке;
2. указываем валентности, обращая внимание на название. Если валентность первого элемента переменная, она будет указана. Валентность второго элемента - низшая;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс.

Определим формулу оксида серы:
1. записываем знаки S и О.
2. валентность серы равна 4, валентность кислорода, как и во всех соединениях - два.
3. наименьшее общее кратное 4
4/2=2, пишем индекс у знака О
4/4=1, пишем индекс у знака S;
4. получилось SО2.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Использованные изображения:
Валентность.
Составление химических формул
по валентности
8 класс
Тип урока. Комбинированный.
Методы обучения. Частично поисковый, репродуктивный, программированный опрос, беседа с элементами лекции.
Эпиграф к уроку. «Всякое вещество – от самого простого до самого сложного – имеет три различные, но взаимосвязанные стороны: свойства, состав, строение…» (Б.М.Кедров).
Цели. Дидактическая: рассмотреть понятие «валентность» как атомность элемента, познакомить учащихся с различными видами валентности (высшей и низшей, переменной и постоянной).
Психологическая: вызвать интерес к предмету, выработать умение логически рассуждать, грамотно выражать свои мысли.
Воспитательная: развивать умение работать коллективно, оценивать ответы своих товарищей.
Оборудование. Модели молекул воды, углекислого газа, наборы для построения моделей молекул различных веществ, индивидуальные карточки для проверки домашнего задания и самостоятельной работы учащихся в группе, таблички-анаграммы для химической разминки, шкала для определения эмоционального состояния ученика.
ХОД УРОКА
Ориентировочно-мотивационный этап
Психологическая разминка
Цель разминки – определить эмоциональное состояние учащихся. У каждого ученика на внутренней стороне обложки тетради приклеена табличка с шестью лицами – шкала для определения эмоционального состояния (рис.). Каждый ученик ставит галочку под той рожицей, чье выражение отражает его настроение.
Учитель. Было бы замечательно, если бы к концу урока каждому удалось переместить галочку хотя бы на одну клеточку влево.
Для этого нужно задуматься над вопросами: может ли человек полюбить не очень интересный ему учебный предмет? Что для этого нужно сделать?
Химическая разминка
Разминку готовят и проводят ученики.
Ученик. Анаграммы – это слова, в которых изменен порядок букв. Попробуйте разгадать некоторые из химических анаграмм. Переставьте буквы в каждом слове и получите название химического элемента. Обратите внимание на подсказку.
«Одоврод» – у этого элемента самая маленькая относительная атомная масса.
«Маилинюй» – этот элемент называют «крылатым» металлом.
«Тьурт» – содержится в медицинском градуснике.
«Цалький» – без него наши кости были бы непрочными и хрупкими.
«Росфоф» – веществом, состоящим из атомов этого элемента, была намазана шерсть собаки Баскервилей.
Учитель. Если вы легко разгадали слова-анаграммы, скажите себе: «Я – молодец!»
Химические знаки и химические
формулы
(Проверка домашнего задания)
Индивидуальная работа у доски по карточкам.
Цифровой диктант
Контроль за выполнением диктанта учащиеся осуществляют методом взаимопроверки.
Задание. Напротив правильных утверждений поставьте цифру 1, напротив неверных – 0.
1. Химический элемент – это определенный вид атомов.
2. В каждой клетке таблицы Д.И.Менделеева, помимо обозначения и названия элемента, записаны два числа: верхнее – относительная атомная масса элемента, нижнее – его порядковый номер.
3. Химический элемент галлий был назван так в честь Франции.
4. В таблице Д.И.Менделеева элементы располагаются, как правило, в порядке убывания их атомных масс.
5. Значения относительной атомной массы и массы атома, выраженной в а. е. м., никогда не совпадают численно.
6. Простыми называют вещества, состоящие из атомов одного элемента.
8. Массовая доля элемента показывает, какую часть (долю) составляет масса данного элемента от всей массы вещества.
9. Относительная молекулярная масса воды Н 2 О равна 20.
10. Массовая доля кальция в оксиде кальция СаО составляет 71%.
П р а в и л ь н ы е о т в е т ы: 1 – 1, 2 – 0, 3 – 1, 4 – 0, 5 – 0, 6 – 1, 7 – 0, 8 – 1, 9 – 0, 10 – 1.
Операционно-исполнительный этап
Учитель. Вы знаете, что химические формулы веществ показывают количественные соотношения, в которых атомы соединяются между собой, вы также научились рассчитывать массовую долю элемента по химической формуле вещества. Например, в воде Н 2 О на один атом кислорода приходится два атома водорода, или 11% Н и 89% О. В углекислом газе СО 2 на один атом углерода приходится два атома кислорода. (демонстрация моделей молекул данных веществ.)
Валентность
Учитель. Валентность – это способность атомов присоединять к себе определенное число других атомов.
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HF, NaCl). С атомом двухвалентного элемента соединяются два атома одновалентного (H 2 O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента.
Правила определения валентности
элементов в соединениях
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н 2 О к одному атому кислорода присоединено два атома водорода.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО 2 (углекислый газ) имеет валентность IV.
Учитель. Как определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая (схема).

Высшая валентность равна номеру группы.
Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Учитель. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Для этого удобно воспользоваться следующей таблицей.
Таблица
Алгоритм составления формулы соединения Р и О
Последовательность действий |
Составление формулы оксида фосфора |
1. Написать символы элементов |
|
2. Определить валентности элементов |
|
3. Найти наименьшее общее кратное численных значений валентностей |
|
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов |
10: 5 = 2, 10: 2 = 5; |
5. Записать индексы при символах элементов |
|
6. Формула соединения (оксида) |
Учитель. Запомните еще два правила для составления химических формул соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже. (Демонстрация таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO 3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
Самостоятельная работа
Текст работы заранее написан на доске. Двое учащихся решают задание на обратной стороне доски, остальные в тетрадях.
Задание 1.
Проверьте, правильно ли
написаны формулы следующих соединений: Na 2 S,
KBr, Al 2 O 3 ,
Mg 3 N 2 , MgO.
Задание 2. Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями, происходит взаимопроверка. Учитель может выборочно проверить некоторые тетради, похвалить тех учащихся, которые справились быстрее всех и сделали меньше всего ошибок.
Закрепление изученного материала
Беседа с учащимися по вопросам
1) Что такое валентность?
2) Почему валентность иногда называют атомностью элемента?
3) Чему равны валентности водорода и кислорода?
4) Какие два значения валентности могут проявлять неметаллы?
5) Как определить низшую и высшую валентности неметаллов?
6) Как найти наименьшее общее кратное между численными значениями валентностей?
7) Могут ли атомы в соединении иметь свободные валентности?
8) Какой из двух неметаллов в химической формуле
их соединения занимает 1-е место, а какой –
2-е? Поясните на примере оксида NO 2 , используя
таблицу Д.И.Менделеева.
Творческая работа в группах
Задание. Используя наборы для составления моделей молекул различных веществ, составьте формулы и модели молекул для следующих соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы отчитывается о выполненном задании и вместе с классом приводит анализ ошибок.
Задание на дом. По учебнику «Химия-8» Л.С.Гузея: § 3.1, задания № 3, 4, 5, с. 51. Желающие могут подготовить сообщения о французском ученом Ж.Л.Прусте и английском ученом Дж.Дальтоне.
Рефлексивно-оценочный этап и подведение итогов урока
Объявить оценки за урок отвечавшим ученикам, поблагодарить всех за работу на уроке. Провести оценку эмоционального состояния по шкале (см. рис.). Учитель еще раз напоминает вопросы, над которыми необходимо подумать для эффективной работы на следующем уроке.
Л и т е р а т у р а
Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия-8, М.: Дрофа, 2000; Тыльдсепп А.А., Корк В.А. Мы изучаем химию. М.: Просвещение, 1988; Букреева Р.В., Быканова Т.А. Уроки новых технологий по химии. Воронеж, 1997.